мқҙлҹ° кё°мӮ¬
м–ҙл•Ңмҡ”?
мӢӨмӢңк°„
л№ лҘёлүҙмҠӨ
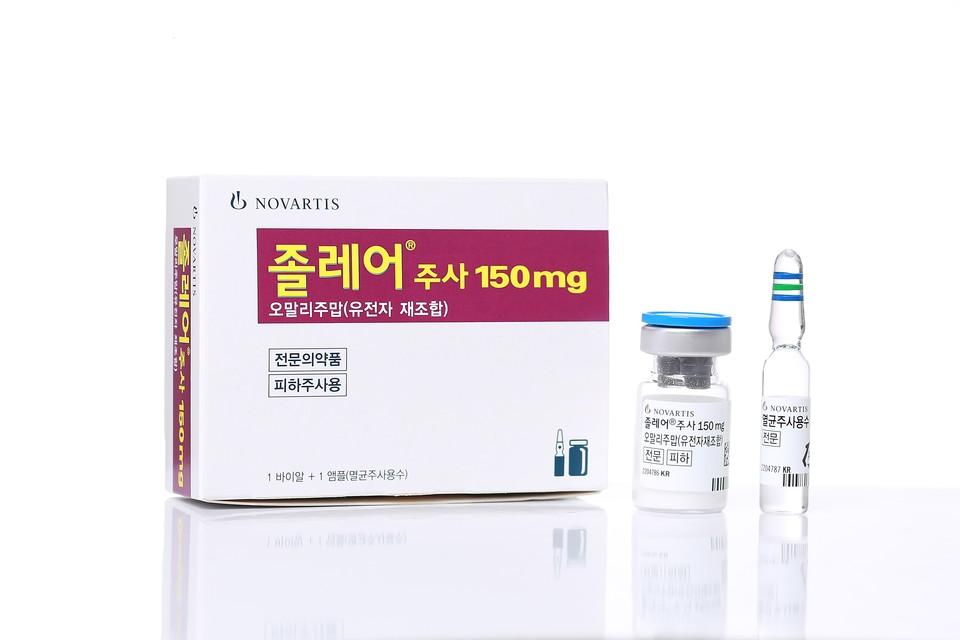
м¶ңмӢң 25лҸҢ л§һмқҖ PPI 'л„ҘмӢңмӣҖ'вҖҰ"мһҘкё° мӮ¬мҡ©м—җлҸ„ мқјкҙҖлҗң нҡЁкіј"
[л©”л””нҢҢлӮҳлүҙмҠӨ = мөңм„ұнӣҲ кё°мһҗ] мң„мӢқлҸ„ м—ӯлҘҳм§Ҳнҷҳ(GERD) м№ҳлЈҢ мҠӨн„°л””м…Җлҹ¬ мқҳм•Ҫн’Ҳмқё 'л„ҘмӢңмӣҖ(м—җмҠӨмҳӨл©”н”„лқјмЎё)'мқҳ м¶ңмӢң 25мЈјл…„мқ„ мЎ°лӘ…н•ҳлҠ” мһҗлҰ¬к°Җ м—ҙл ёлӢӨ. мҶҢнҷ”кё°лӮҙкіј м „л¬ёк°Җл“ӨмқҖ лҢҖн‘ң н”„лЎңнҶӨ нҺҢн”„ м–өм ңм ң(PPI)лЎңм„ң л„ҘмӢңмӣҖмқҙ мһҘкё° мӮ¬мҡ©м—җлҸ„ мқјкҙҖлҗң нҡЁкіјмҷҖ мҡ°мҲҳн•ң мҰқмғҒ к°ңм„ мқ„ ліҙмқё м•Ҫм ңлқј нҸүк°Җн–ҲлӢӨ. 20мқј н•ңкөӯм•„мҠӨнҠёлқјм ңл„Өм№ҙлҠ” м„ңмҡё мЎ°м„ нҢ°лҰ¬мҠӨ к°•лӮЁм—җм„ң мң„мӢқлҸ„ м—ӯлҘҳм§Ҳнҷҳ(GERD) м№ҳлЈҢм ң л„ҘмӢңмӣҖ көӯлӮҙ м¶ңмӢң 25мЈјл…„мқ„ кё°л…җн•ң кё°мһҗк°„лӢҙнҡҢлҘј к°ңмөңн–ҲлӢӨ. л„ҘмӢңмӣҖмқҖ мң„мӮ° 분비лҘј м–өм ңн•ҳлҠ” кё°м „мқ„ к°Җ진 PPI кі„м—ҙ м№ҳлЈҢм ңлЎң, м§ҖлӮң 2000л…„ мҠ№мқёлҗҗлӢӨ. мқҙнӣ„
мӮјмқјм ңм•Ҫ, мӢ мң м„қ мӮ¬мһҘ мӮ¬лӮҙмқҙмӮ¬ м„ мһ„нӮӨлЎңвҖҰ2мқё лҢҖн‘ң мІҙм ң лҗҳлӮҳ
[л©”л””нҢҢлӮҳлүҙмҠӨ = мқҙм •мҲҳ кё°мһҗ] мӮјмқјм ңм•Ҫмқҙ мӢ мң м„қ мӮ¬мһҘ мӮ¬лӮҙмқҙмӮ¬ м„ мһ„мқ„ 추진н•ңлӢӨ. мҳӨл„Ҳ лӢЁлҸ… кІҪмҳҒ мІҙм ңм—җм„ң 2мқё лҢҖн‘ң мІҙм ңлЎң мһ¬м „нҷҳлҗ м§Җ мЈјлӘ©лҗңлӢӨ. мӮјмқјм ңм•ҪмқҖ 20мқј 'мЈјмЈјмҙқнҡҢмҶҢ집 кІ°мқҳ'лҘј нҶөн•ҙ лӮҙлӢ¬ 21мқј м—ҙлҰ¬лҠ” м •кё°мЈјмЈјмҙқнҡҢм—җм„ң мӮ¬лӮҙмқҙмӮ¬ 3лӘ…, мӮ¬мҷёмқҙмӮ¬ 1лӘ… л“ұ л“ұкё°мһ„мӣҗ 4лӘ…мқ„ м„ мһ„н•ҳлҠ” м•Ҳкұҙмқ„ мӢ¬мқҳн• кІғмқҙлқјкі кіөмӢңн–ҲлӢӨ. 4лӘ… мӨ‘ н—ҲмҠ№лІ” лҢҖн‘ңмқҙмӮ¬ нҡҢмһҘкіј н—ҲмӨҖлІ” мӮ¬лӮҙмқҙмӮ¬ м „л¬ҙ, к№Җм°Ҫнҳё мӮ¬мҷёмқҙмӮ¬ л“ұ 3лӘ…мқҖ мһ¬м„ мһ„мқҙкі , лӮҳлЁём§Җ мӢ мң м„қ мӮ¬лӮҙмқҙмӮ¬ мӮ¬мһҘмқҖ мӢ к·ң м„ мһ„мқҙлӢӨ. мӢ мң м„қ мӮ¬мһҘмқҖ м§ҖлӮңн•ҙ 9мӣ” к№ҖмғҒ진 м „ к°Ғмһҗ лҢҖн‘ңмқҙмӮ¬ мӮ¬мһҘ мӮ¬мһ„ м§Ғнӣ„ мҳҒмһ…
мӮјм„ұл°”мқҙмҳӨм—җн”јмҠӨ, мҳ¬н•ҙ л‘җ лІҲм§ё мӮ°н•ҷнҳ‘л Ҙ мӢңмғҒмӢқ к°ңмөң
мӮјм„ұл°”мқҙмҳӨм—җн”јмҠӨ(лҢҖн‘ңмқҙмӮ¬ к№ҖкІҪм•„ мӮ¬мһҘ)к°Җ 20мқј кі л ӨлҢҖн•ҷкөҗ мһҗм—°кі„ мә нҚјмҠӨм—җм„ң 'м—°кө¬л…ёнҠё кІҪ진лҢҖнҡҢ' мӢңмғҒмӢқмқ„ м—ҙкі мғқлӘ…кіјн•ҷлҢҖн•ҷ лҢҖн•ҷмӣҗмғқл“Өм—җкІҢ мҡ°мҲҳ мғҒнҢЁмҷҖ мҙқ 1000л§Ңмӣҗ к·ңлӘЁмқҳ мһҘн•ҷкёҲмқ„ м „лӢ¬н–ҲлӢӨ. м—°кө¬л…ёнҠёлҠ” мӢңмһ‘л¶Җн„° кІ°кіјл¬ј ліҙкі , л°ңн‘ң л°Ҹ м§Җм Ғмһ¬мӮ°к¶Ң нҷ•ліҙ л“ұм—җ мқҙлҘҙкё°к№Ңм§Җ м „ кіјм •м—җм„ңмқҳ м—°кө¬ м„ұкіјлҘј кё°лЎқн•ң мһҗлЈҢлӢӨ. м—°кө¬л…ёнҠёлҠ” м—°кө¬мқҳ м§ҖмҶҚм„ұ мң м§Җ л°Ҹ кІ°кіј ліҙнҳё, л…јл¬ё л°ңн‘ң, нҠ№н—Ҳ м¶ңмӣҗ л•Ңмқҳ кё°мҙҲ мһҗлЈҢлЎң нҷңмҡ©лҗңлӢӨ. мӮјм„ұл°”мқҙмҳӨм—җн”јмҠӨлҠ” көӯлӮҙ мЈјмҡ” лҢҖн•ҷкөҗмҷҖмқҳ нҳ‘м•Ҫмқ„ нҶөн•ҙ м—°кө¬л…ёнҠё мһ‘м„ұлІ•мқ„ көҗмңЎн•ҳкі , мӢңмғҒмӢқмқ„ нҶөн•ҙ мҡ°мҲҳ н•ҷмғқл“Өм—җкІҢ мһҘн•ҷкёҲмқ„ мҲҳм—¬н•ҳ
-
мөңкҙ‘нӣҲ нҡҢмһҘ "мһҗлһ‘мҠӨлҹ¬мӣҖВ·к°җмӮ¬ көҗм°ЁвҖҰм•ҪмӮ¬ мӮ¬лӘ…к°җ кі„мҶҚлҗ кІғ"
[л©”л””нҢҢлӮҳлүҙмҠӨ = мЎ°н•ҙ진 кё°мһҗ] мөңкҙ‘нӣҲ лҢҖн•ңм•ҪмӮ¬нҡҢмһҘмқҙ лҢҖн•ңм•ҪмӮ¬нҡҢ мқҙмӮ¬нҡҢлҘј нҶөн•ҙ к·ёлҸҷм•Ҳмқҳ мҶҢнҡҢлҘј м „н•ҳкі , м§ҖлӮңн•ҙ кІ°мӮ°кіј мҳ¬н•ҙ мҳҲмӮ°, мғҲлЎңмҡҙ CI мҡҙмҡ©, кұҙк°•кё°лҠҘмӢқн’Ҳ м•Ҳм „мң„мғқкөҗмңЎ мӢңн–үк·ңм • м ңм • л“ұмқ„ мқҳкІ°н–ҲлӢӨ. лҢҖн•ңм•ҪмӮ¬нҡҢлҠ” 20мқј мҳӨнӣ„ лҢҖн•ңм•ҪмӮ¬нҡҢкҙҖ 4мёө к°•лӢ№м—җм„ң '2025л…„
-
м—¬м•ҪмӮ¬ 비л‘ҳкё°нҡҢ, м—¬м„ұл…ёмҲҷмқё мүјн„°м—җ нӣ„мӣҗкёҲ 2000л§Ңмӣҗ м „лӢ¬
비л‘ҳкё°нҡҢ (нҡҢмһҘ к°•нқ¬мңӨ)лҠ” мӮ¬нҡҢкіөн—ҢмӮ¬м—…мқҳ мқјнҷҳмңјлЎң 19мқј м„ңлҢҖл¬ёкө¬ м—¬м„ұ л…ёмҲҷмқё мүјн„° л””л”Өм„јн„°лҘј л°©л¬ён•ҙ нӣ„мӣҗкёҲ 200л§Ңмӣҗмқ„ м „лӢ¬н–ҲлӢӨ. м—ҙлҰ°ліөм§Җ л””л”Өм„јн„°лҠ” лҢҖн•ңлҜјкөӯ мң мқјн•ң м—¬м„ұ л…ёмҲҷмқё мүјн„° мӢңм„ӨмқҙлӢӨ. мқјм •н•ң мЈјкұ°к°Җ м—Ҷкұ°лӮҳ мЈјкұ°лҘј мһғмқ„ мң„кё°м—җ мһҲлҠ” м—¬м„ұл“Өмқҙ л…ёмҲҷмқҳ мң„н—ҳмқ„ лІ—
-
кіөлӢЁ м •кё°м„қ мқҙмӮ¬мһҘ "м Ғм •м§„лЈҢ мң лҸ„ мң„н•ң кёүм—¬ 분м„қ к°•нҷ”н• кІғ"
[л©”л””нҢҢлӮҳлүҙмҠӨ = к№Җмӣҗм • кё°мһҗ] көӯлҜјкұҙк°•ліҙн—ҳкіөлӢЁмқҙ мҲҳмһ… кё°л°ҳмқ„ к°•нҷ”н•ҳкі м§Җм¶ңнҡЁмңЁнҷ”лқјлҠ” л‘җ 축мңјлЎң кұҙк°•ліҙн—ҳ мһ¬м • кұҙм „м„ұмқ„ мң м§Җн• л°©м№ЁмқҙлӢӨ. нҠ№нһҲ кёүм—¬кҙҖлҰ¬кё°лҠҘмқ„ к°•нҷ”н•ҙ м Ғм •м§„лЈҢлҘј мң лҸ„н•ҳкІ лӢӨлҠ” мқҳм§ҖлҘј н‘ңлӘ…н–ҲлӢӨ. кёүм—¬кё°мӨҖ л“ұм—җлҠ” л¶Җн•©н•ҳм§Җл§Ң мқҙмғҒн•ӯлӘ©мңјлЎң 분м„қлҗң мӮ¬н•ӯм—җ лҢҖн•ҙм„ңлҠ”
-
лҸҷм•„ST, лҮҢм „мҰқ мӢ м•Ҫ 'м„ёл…ёл°”л©”мқҙнҠё' н’ҲлӘ©н—Ҳк°Җ мӢ мІӯ
лҸҷм•„м—җмҠӨнӢ°лҠ” мӢқн’Ҳмқҳм•Ҫн’Ҳм•Ҳм „мІҳм—җ лҮҢм „мҰқ мӢ м•Ҫ 'м„ёл…ёл°”л©”мқҙнҠё' н’ҲлӘ©н—Ҳк°ҖлҘј мӢ мІӯн–ҲлӢӨкі 20мқј л°қнҳ”лӢӨ. лҸҷм•„м—җмҠӨнӢ°лҠ” м§ҖлӮңн—Ө 1мӣ” SKл°”мқҙмҳӨнҢңкіј м„ёл…ёл°”л©”мқҙнҠё лқјмқҙм„ мҠӨмқё кі„м•Ҫмқ„ мІҙкІ°н–ҲлӢӨ. лҸҷм•„м—җмҠӨнӢ°лҠ” SKл°”мқҙмҳӨнҢңмңјлЎңл¶Җн„° м„ёл…ёл°”л©”мқҙнҠё көӯлӮҙмҷё 30к°ңкөӯ кіөкёүмқ„ мң„н•ң мҷ„м ңмқҳм•Ҫн’Ҳ(DP)
лӢ№мӢ мқҙ
мқҪмқҖ분야
мЈјмҡ”кё°мӮ¬
 м№ҙм№ҙмҳӨмұ„л„җ추к°Җ
м№ҙм№ҙмҳӨмұ„л„җ추к°Җ













![[нҳ„мһҘ] '2024 м„ёкі„ л°”мқҙмҳӨ м„ңл°Ӣ' мқёмІңм„ң к°ңл§ү](/upload/editor/20241111141025_22E07.jpg)
![[нҸ¬нҶ ] л°•лҜјмҲҳ 2м°ЁкҙҖ, м ңмЈјлҸ„ л°©л¬ёвҖҰмғҒкёүмў…лі‘ м§Җм • нҳ„мһҘм җкІҖ](/upload/editor/20241108102827_ACFD7.jpg)

лҸ…мһҗмқҳкІ¬
мһ‘м„ұмһҗ 비л°ҖлІҲнҳё
0/200